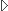|
|
||||
Бор-нейтронозахватная терапия помогает победить ракУченые ИЯФ СО РАН смогли ликвидировать 99% опухолевых клеток головного мозга с помощью ускорителя для бор-нейтронозахватной терапии, сообщил и.о. заведующего лабораторией БНЗТ Сергей Таскаев.  Бор-нейтронозахватная терапия (БНЗТ) осуществляется в два этапа: сначала пациенту вводят препарат, в котором есть стабильный изотоп бора – бор-10. Быстро растущие больные клетки накапливают это вещество гораздо больше, чем рядом расположенные здоровые. В результате оно собирается преимущественно в опухоли. Второй шаг: пациента облучают нейтронами, а те, в свою очередь, хорошо захватываются ядрами бора. Когда это случается, происходит ядерная реакция, в результате которой образованное ядро разваливается на альфа-частицу и ядро лития. Они, разлетаясь в противоположные стороны, имеют большую энергию и быстро тормозятся практически в пределах одной клетки живого организма. В результате, если она раковая, то погибает. Поскольку здоровые клетки накапливают бор в гораздо меньшей концентрации, они остаются жить. Бор-нейтронозахватная терапия (БНЗТ) осуществляется в два этапа: сначала пациенту вводят препарат, в котором есть стабильный изотоп бора – бор-10. Быстро растущие больные клетки накапливают это вещество гораздо больше, чем рядом расположенные здоровые. В результате оно собирается преимущественно в опухоли. Второй шаг: пациента облучают нейтронами, а те, в свою очередь, хорошо захватываются ядрами бора. Когда это случается, происходит ядерная реакция, в результате которой образованное ядро разваливается на альфа-частицу и ядро лития. Они, разлетаясь в противоположные стороны, имеют большую энергию и быстро тормозятся практически в пределах одной клетки живого организма. В результате, если она раковая, то погибает. Поскольку здоровые клетки накапливают бор в гораздо меньшей концентрации, они остаются жить.Бор-нейтронозахватная терапия позволяет бороться с такими опухолями, которые в настоящее время не поддаются лечению никакими другими методами. Например, глиобластомы мозга. Пациенту с таким диагнозом обычно отводится один год жизни. Химиотерапия и другие применяющиеся сегодня средства могут продлить этот срок максимум на полгода.
У БНЗТ длинная история развития, со своими взлетами и падениями. Методика была предложена достаточно давно, еще в 1936 году, через четыре года после того, как открыли нейтрон. Затем ее отрабатывали на ядерных реакторах. В 70-80-е годы японский хирург Хироши Хатанака проводил терапию и получил впечатляющие результаты. Фактически, хирургическую операцию у людей с глиобластомой он делал прямо на реакторе — специально для этого там была оборудована стерильная хирургическая комната. Вскрывал череп, вырезал основную часть опухоли (всю — опасно, можно повредить некоторые функции мозга), вводил бор, облучал это место потоком тепловых нейтронов и действительно вылечивал. Его первый пациент, которому поставили диагноз глиобластома, прожил после этого 21 год.
Затем развитие методики продолжалось на ряде других реакторов во всем мире, и возникло предложение усовершенствовать ее, проводя лечение без хирургического вмешательства. Для этого требовалась несколько бОльшая энергия нейтронов — надтеплового диапазона, чтобы они смогли проникнуть глубже в организм — туда, где находится опухоль. Результаты получились вполне обнадеживающие, но тут произошла катастрофа на Чернобыльской АЭС и как следствие, многие ядерные реакторы были закрыты. Одновременно с этим возникло понимание: нейтроны можно получать также на ускорителях заряженных частиц. Там ускоренный пучок попадает на мишень, где в результате происходят ядерные реакции и возникают нейтроны. Такого рода установки, к тому же, больше подходят для применения в клиниках.
«Чтобы методика БНЗТ была пригодна для внедрения в медицину, должны выполняться два основных требования. Первое: необходимы такие препараты адресной доставки бора, которые обеспечивали бы накопление его в опухолевых клетках в достаточно высокой концентрации, в несколько раз превосходящей содержание его в рядом расположенных здоровых тканях. Второе: нужно создать пучок нейтронов с энергиями надтеплового диапазона, не быстрых, не медленных, а промежуточных. Оказалось, что сгенерировать его очень трудно», — рассказывает Сергей Юрьевич Таскаев, ведущий научный сотрудник лаборатории БНЗТ, созданной в ИЯФ СО РАН в рамках проекта Российского научного фонда (РНФ). Кроме требования к качеству, существует еще требование к количеству: поток этих нейтронов должен быть достаточно большим. Терапию нельзя растянуть на много сеансов. Это обусловлено, в том числе, спецификой действия препаратов, доставляющих бор. Один раз можно «обмануть» организм, заставив его накопить это вещество, но во второй-третий уже сработают защитные механизмы и лечения не получится. Отсюда изначальное требование, которое было сформулировано еще 30 лет назад: БНЗТ надо проводить в течение примерно одного часа. Именно поэтому поток нейтронов должен быть достаточно большим.
В начале 90-х годов имеющиеся ускорители обеспечивали ток протонов в 10-30 раз меньший, чем требовалось. Необходимо было увеличить его, как минимум, десятикратно. Задача оказалась невероятно сложной. Ее удалось решить только через четверть века. В 2015 году практически одновременно на трех разных ускорителях был получен протонный пучок с требуемым током. Это высоковольтный ускоритель Динамитрон бельгийской компании Ion Beam Application для университета Нагоя в Японии, высоковольтный ускоритель Hyperion американской Neutron Therapeutics Inc. (ранее GT Advanced Technologies) и тандемный ускоритель ИЯФ СО РАН. Еще два проекта, которые, кажется, могут достичь такого уровня, работают с радиочастотными ускорителями - линаками. Их делают компания Mitsubishi для университета Цукубы и Hitachi для национальной онкологической клиники Токио. Таким образом, в ближайшее время должно появиться сразу несколько центров, каждый со своим уникальным ускорителем, и там начнется лечение пациентов с помощью бор-нейтронозахватной терапии.
Разработка ИЯФ СО РАН называется «Ускоритель-тандем с вакуумной изоляцией». Его английская аббревиатура — VITA (читается как лат. «жизнь»).
«Для решения задачи генерации нейтронов предложили использовать ускоритель очень необычной схемы. Был огромный риск, что вообще ничего не получится, – рассказывает Сергей Таскаев. – Нам пришлось пройти очень длинный путь. В 2003 году мы начали изготавливать установку, в 2007 она наконец заработала, но только в конце в 2015 был получен пучок протонов, с током, близким к требуемому».
Приступив к проекту, ученые не имели достаточного опыта. Его пришлось набирать, проходя через долгие периоды неудач, сомнений и пересмотра технических решений. Основное, что ставилось во главу угла — это выбирать из последних наилучшие, несмотря на трудности их реализации. Так, когда исследователи начинали, в одной очень авторитетной научной статье 2003 года было написано, что, конечно, лучшей мишенью для генерации нейтронов является литиевая, но, кажется, она практически нереализуема. Тем не менее, такая мишень была создана и успешно функционирует (причем, не только в Новосибирске).
Ускоритель-тандем с вакуумной изоляцией — проект сложный, разноплановый. В его реализации участвовало много сотрудников ИЯФ СО РАН, других организаций России и всего мира. Коллектив исследователей постоянно меняется в зависимости от задач, которые встают перед учеными.
Новизна проекта привлекла к себе молодых, заинтересованных и амбициозных исследователей и, что немаловажно, достаточно большое финансирование. Установка разработана и изготовлена на средства различных грантов, сначала международных, а в последнее десятилетие — российских, прежде всего, в рамках федеральных целевых программ Минобрнауки и крупного проекта РНФ.
Ускоритель для БНЗ-терапии
«В декабре прошлого года мы получили на VITA стационарный протонный пучок с током 5 мА — по-видимому, максимум, доступный в текущей конфигурации установки. Этот результат доказывает, что такой тип ускорителя заряженных частиц имеет перспективы использования для БНЗТ, — рассказывает Сергей Таскаев. — 2015 год для нас был очень удачным. Мы перешли на такой режим, когда стабильно получаем протонный пучок и генерируем нейтроны. Недавно мы решились на то, чтобы совместно с японцами из клиники Университета Цукубы провести эксперимент— нужно было в течение недели обеспечивать непрерывный поток нейтронов. Результат получили, вроде, вполне предсказуемый — чем больше концентрация бора в больных клетках, тем лучше они гибнут под нейтронным излучением — но зато гарантированно подтверждающий качество ускорителя».
Казалось бы, установка уже практически готова для того, чтобы начать вводить ее в медицину. Но тут возникает серьезная проблема. В нашей стране пока нет клиники, готовой начать внедрять новую методику. Гораздо привычнее через 10 лет купить все у японцев (которые, кстати, располагают не только государственными, но и частными деньгами).
«Если еще год назад мы не были уверены в успехе, поскольку не удавалось получать требуемый протонный пучок, то сейчас мы отчетливо понимаем, что можем сделать такой источник нейтронов для тех, кому он нужен. Но вряд ли в России кто-то сейчас готов вложиться в эту методику. Я вижу, что в ближайшие пять лет проведение терапии будет осуществлено где-нибудь за рубежом, и тогда наши клиники тоже захотят», — сетует Сергей Таскаев.
Тем не менее, ученые не теряют оптимизма. Перед самым новым годом облучили на установке мышей с привитыми опухолями — и это продлило животным жизнь. В первую неделю марта опять приезжают коллеги из Цукубы – будут пробовать новые препараты адресной доставки бора. Ученые делают новую нейтроногенерирующую мишень, создают систему формирования пучка нейтронов, идеальную для БНЗТ, совершенствуют конструкцию и режимы работы с целью создания установки, пригодной для реальной терапии.
«Мне бы хотелось, чтобы наша разработка все-таки дошла до медицинской практики. Но как это получится — не знаю. 15 лет тому назад хотелось сделать новый ускоритель. Вышло. Надеюсь, и дальше все получится», — говорит ученый Эксперимент ставился на клеточных структурах человека из лаборатории позвоночных Института цитологии РАН. Клетки были поражены глиомой и глиобластомой, эти опухоли неизлечимы при современном уровне развития медицины. Опыту предшествовала совместная работа с японскими физиками. В Японии ведутся работы по созданию такого рода ускорителей. По словам Таскаева, скоро будут запущены семь таких установок для лечения больных.
Создание подобной установки обойдется не меньше, чем в 10 миллионов долларов.
«Массового распространения методики не будет. Это возможно только после накопления статистики, тогда к нам придут инвесторы», — заметил Таскаев. По его мнению, в России сегодня необходимы хотя бы три таких центра.
За рубежом уже проявили интерес к ускорителю. Таскаев встречался с китайским бизнесменом, но договоренностей пока нет. «Надо понимать, что только мы знаем секреты этой установки», — подчеркнул Таскаев.
Скорее всего, такая установка для лечения появится в Томске. Почему выбран именно этот сибирский город, ученый уточнять не стал. В любом случае для этого необходимо не менее двух лет.
Новосибирский образец останется дома, его будут использовать для улучшения методик лечения и совершенствования самого ускорителя.
Глиома — самое частое онкозаболевание головного мозга, занимает второе место по злокачественным опухолям у детей. Глиобластома головного мозга – самая злокачественная опухоль ЦНС. Врачи могут лишь немного продлить жизнь пациента, как это случилось, например, с Жанной Фриске и Валерием Золотухиным.
Образование и Православие / По материалам Sibnet и Наука в Сибири |
||||
|
|
Всего голосов: 4 | |||
| Версия для печати | Просмотров: 3375 | |||
|
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||